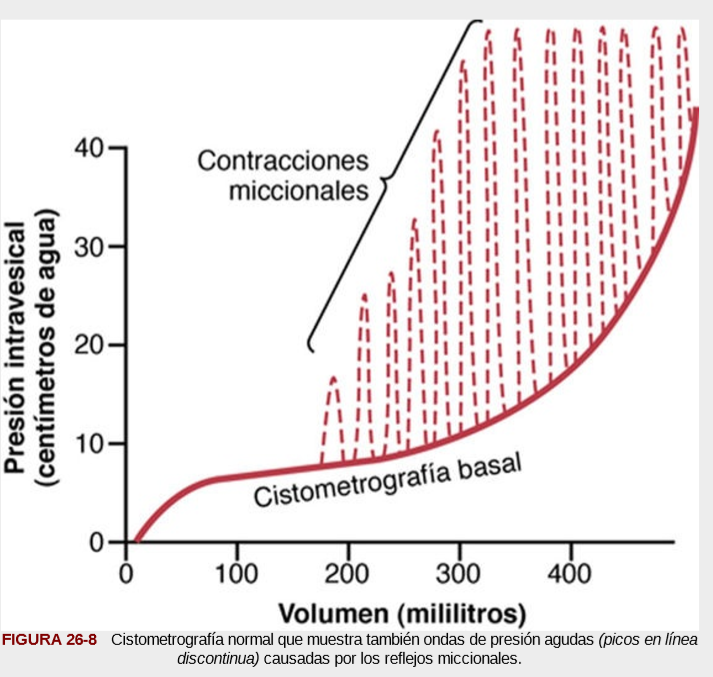
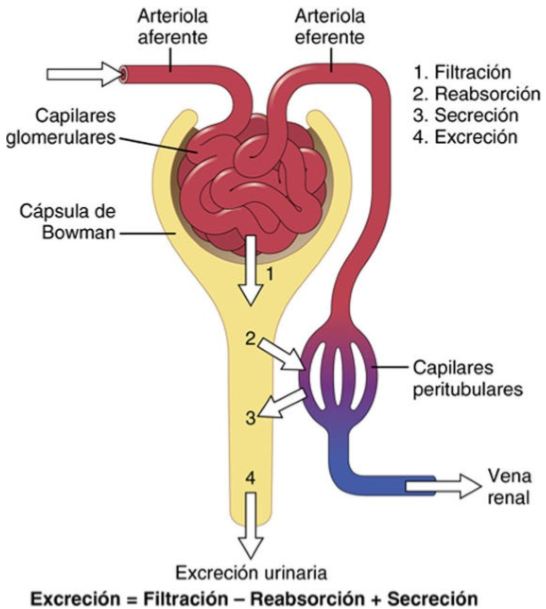
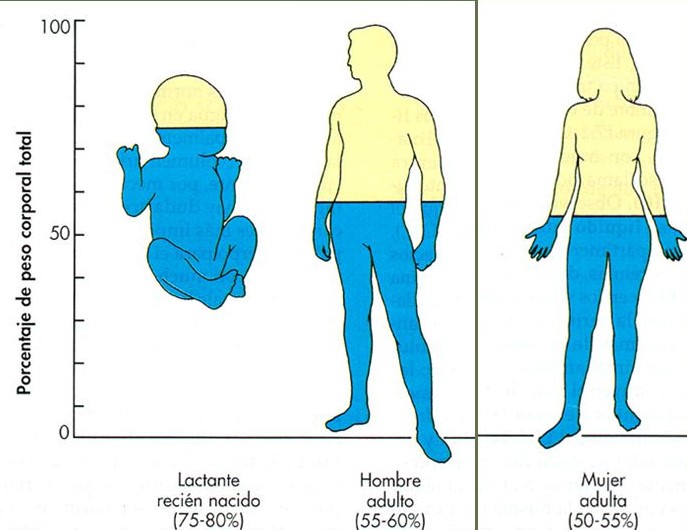
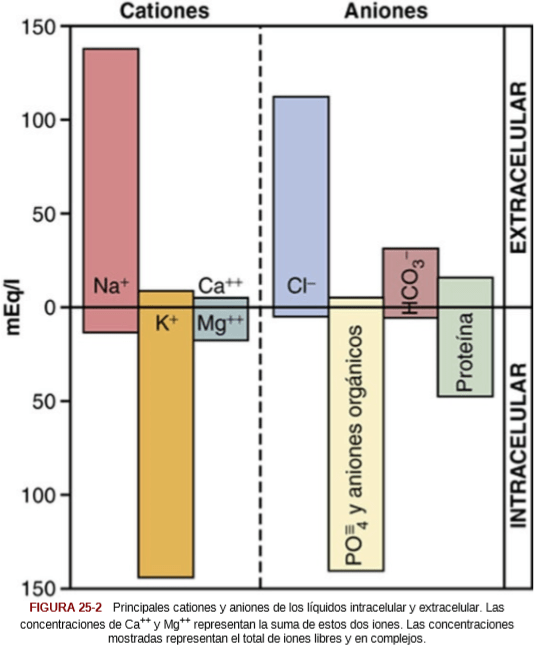
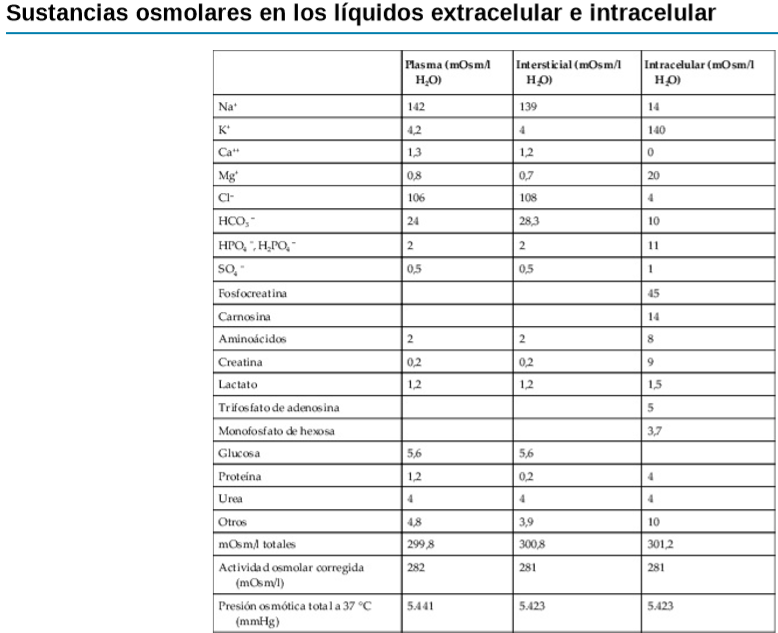
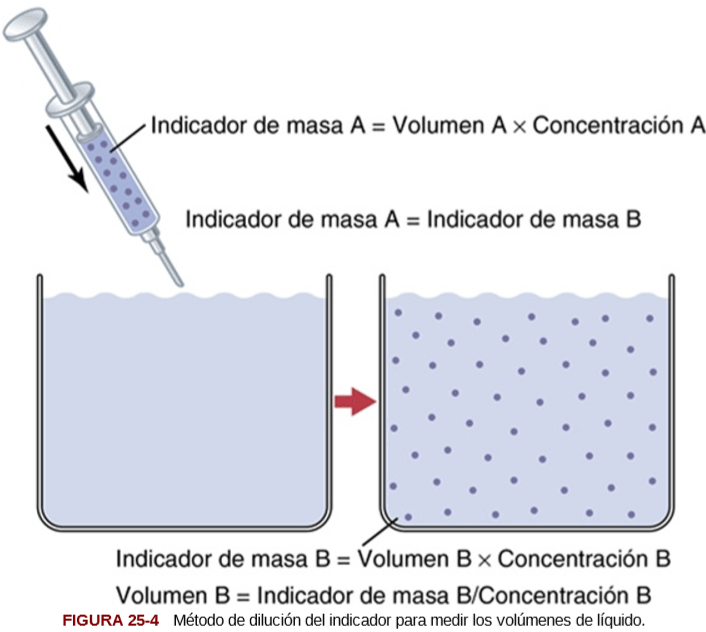
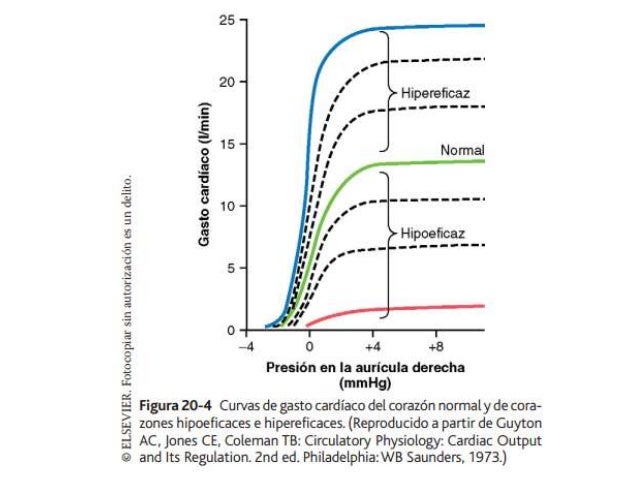
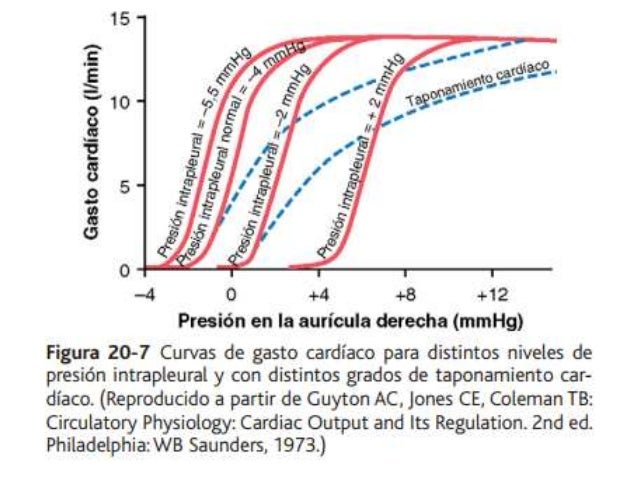
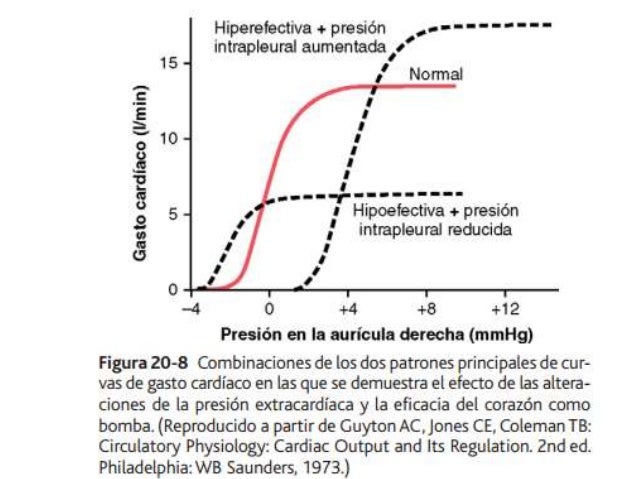
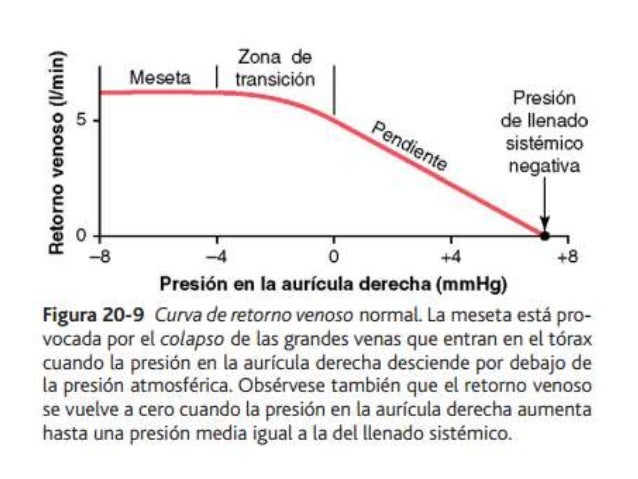
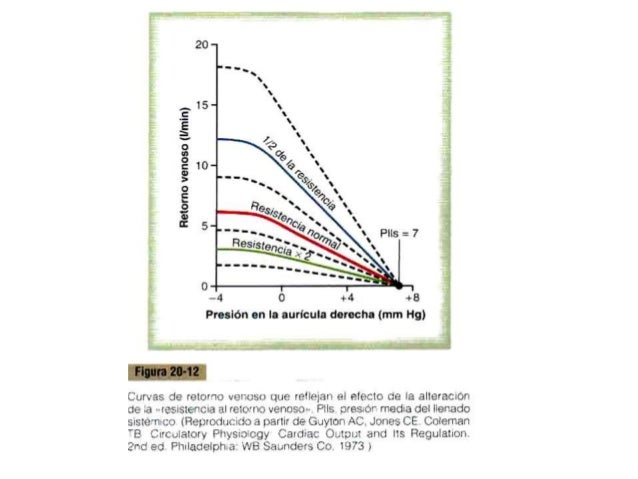
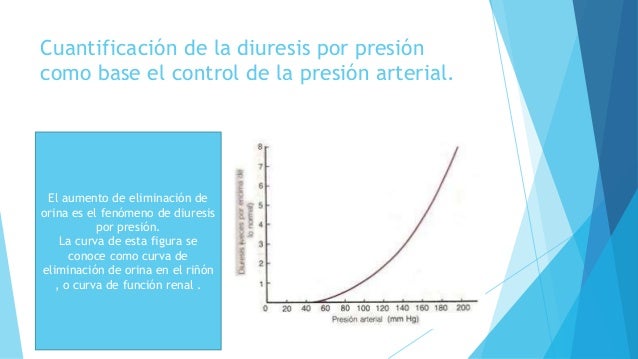
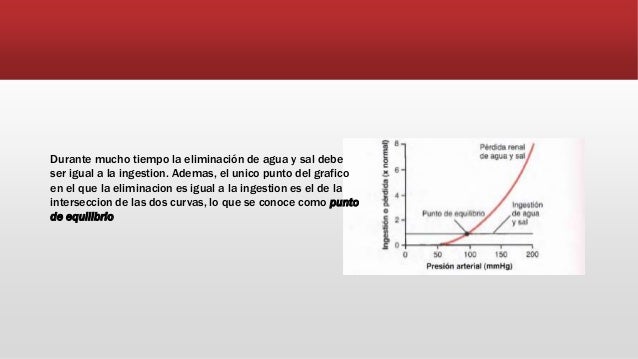
UNIDAD V: LOS LIQUIDOS CORPORALES Y LOS RIÑONES.
CAPITULO 27.
El primer paso en la formación de orina es la filtración de grandes cantidades de líquidos a través de los capilares glomerulares en la cápsula de Bowman, casi 180 l al día. La alta tasa de filtración glomerular depende de la alta tasa de flujo sanguíneo renal, así como de las propiedades especiales de las membranas de los capilares glomerulares.
Composición del filtrado glomerular
Los capilares glomerulares son relativamente impermeables a las proteínas, de manera que el líquido filtrado (llamado filtrado glomerular) carece prácticamente de proteínas y elementos celulares, incluidos los eritrocitos. Las concentraciones de otros constituyentes del filtrado glomerular, como la mayoría de las sales y moléculas orgánicas, son similares a las concentraciones en el plasma. Las excepciones a esta generalización son algunas sustancias con un peso molecular bajo, como el calcio y los ácidos grasos, que no se filtran libremente porque están unidas parcialmente a las proteínas plasmáticas y estas porciones unidas no se filtran a través de los capilares glomerulares.
La FG es alrededor del 20% del flujo plasmático renal
La FG está determinada por: 1) el equilibrio entre las fuerzas hidrostáticas y coloidosmóticas que actúa a través de la membrana capilar, y 2) el coeficiente de filtración capilar (Kf), el producto de la permeabilidad por el área superficial de filtro de los capilares.

En el adulto medio, la FG es de unos 125 ml/min, o 180 l/día. La fracción del flujo plasmático renal que se filtra (la fracción de filtración) es de media de 0,2, lo que significa que alrededor del 20% del plasma que fluye a través del riñón se filtra a través de los capilares glomerulares
Membrana capilar glomerular
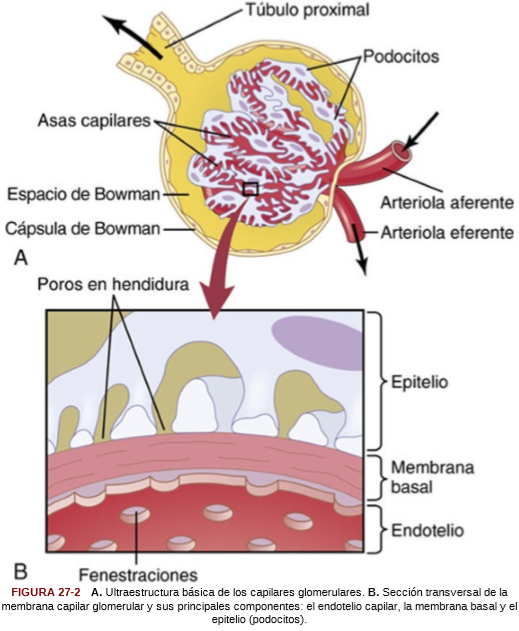
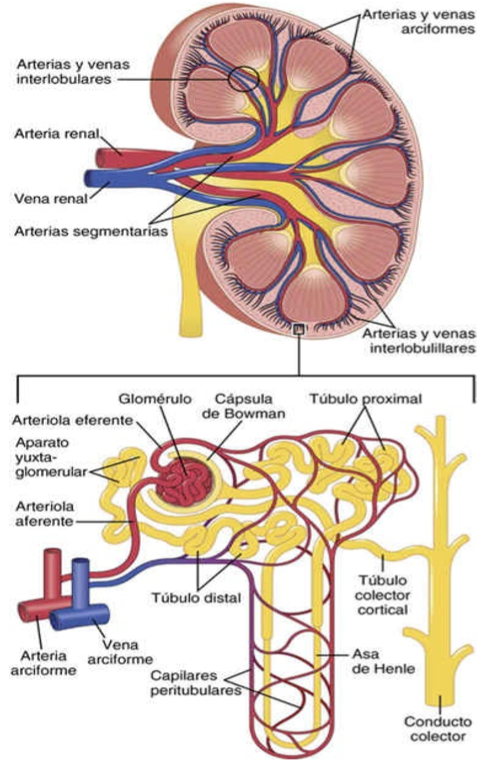
La membrana capilar glomerular es similar a la de otros capilares, excepto en que tiene tres capas principales (en lugar de las dos habituales): 1) el endotelio del capilar; 2) una membrana basal, y 3) una capa de células epiteliales (podocitos) rodeando a la superficie externa de la membrana basal capilar, estas capas forman la barrera de filtración; la membrana capilar glomerular evita normalmente la filtración de proteínas plasmáticas.
El endotelio capilar está perforado por cientos de pequeños agujeros, llamados
fenestraciones.
La membrana basal consta de una red de colágeno y fibrillas de proteoglucanos que tienen grandes espacios a través de los cuales pueden filtrarse grandes cantidades de agua y de solutos. La membrana basal evita con eficacia la filtración de proteínas plasmáticas, en parte debido a las cargas eléctricas negativas fuertes de los proteoglucanos.
La parte final de la membrana glomerular es una capa de células epiteliales que recubre la superficie externa del glomérulo. Estas células no son continuas, sino que tienen unas prolongaciones largas similares a pies (podocitos) que rodean la superficie externa de los capilares. Los podocitos están separados por espacios llamados poros en hendidura a través de los cuales se mueve el filtrado glomerular.
Determinantes de la FG
La FG está determinada por: 1) la suma de las fuerzas hidrostática y coloidosmótica a través de la membrana glomerular, que da lugar a la presión de filtración neta, y 2) el coeficiente glomerular Kf. La filtración glomerular (FG) es igual al producto del Kf y de la presión de filtración neta:

La presión de filtración neta representa la suma de las fuerzas hidrostática y coloidosmótica que favorecen o se oponen a la filtración a través de los capilares glomerulares (fig. 27-4).
Estas fuerzas son:
1) la presión hidrostática dentro de los capilares glomerulares (presión hidrostática glomerular, PG), que favorece la filtración
2) la presión hidrostática en la cápsula de Bowman (PB) fuera de los capilares, que se opone a la filtración
3) la presión coloidosmótica de las proteínas plasmáticas en el capilar glomerular (πG), que se opone a la filtración
4) la presión coloidosmótica de las proteínas en la cápsula de Bowman (πB), que favorece la filtración. (En condiciones normales, la concentración de proteínas en el filtrado glomerular es tan baja que la presión coloidosmótica en el líquido de la cápsula de Bowman se considera cero.)

El aumento del coeficiente de filtración capilar glomerular incrementa la FG
El Kf es una medida del producto de la conductividad hidráulica y el área superficial de los capilares glomerulares. El Kf no puede medirse directamente, pero se calcula experimentalmente dividiendo la FG entre la presión de filtración neta:

Aunque el aumento del Kf eleva la FG y la reducción del Kf la reduce, los cambios en Kf probablemente no constituyen un mecanismo importante de regulación normal día a día de la FG. Pero algunas enfermedades reducen el Kf al reducir el número de capilares glomerulares funcionantes (reduciendo así el área superficial para la filtración) o aumentando el espesor de la membrana capilar glomerular y reduciendo su conductividad hidráulica.
El aumento de la presión hidrostática en la cápsula de Bowman reduce la FG
El aumento de la presión hidrostática en la cápsula de Bowman reduce la FG, mientras que reducir la presión aumenta la FG. Pero los cambios en la presión de la cápsula de Bowman no son normalmente un mecanismo importante de regulación de la FG. En ciertos estados patológicos asociados a la obstrucción de la vía urinaria, la presión en la cápsula de Bowman puede aumentar mucho y provocar una reducción grave de la FG.
El aumento de la presión coloidosmótica capilar glomerular reduce la FG
A medida que la sangre pasa desde la arteriola aferente a través de los capilares glomerulares hasta las arteriolas eferentes, la concentración plasmática de las proteínas aumenta alrededor de un 20% . La razón de este aumento es que alrededor de una quinta parte del líquido en los capilares se filtra a la cápsula de Bowman, lo que concentra las proteínas plasmáticas glomerulares que no se filtran.

Dos factores que influyen en la presión coloidosmótica capilar glomerular son: 1) la presión coloidosmótica del plasma arterial, y 2) la fracción del plasma filtrada por los capilares glomerulares (fracción de filtración). El aumento de la presión coloidosmótica del plasma arterial eleva la presión coloidosmótica capilar glomerular, lo que a su vez reduce la FG. Aumentar la fracción de filtración también concentra las proteínas plasmáticas y eleva la presión coloidosmótica glomerular.
Flujo sanguíneo renal
En un hombre de 70 kg, el flujo sanguíneo combinado a través de los dos riñones es de unos 1.100 ml/min, o un 22% del gasto cardíaco. Como en otros tejidos, el flujo sanguíneo aporta a los riñones nutrientes y se lleva los productos de desecho. Pero el elevado flujo renal supera mucho sus necesidades. El objetivo de este flujo adicional es aportar suficiente plasma para la elevada filtración glomerular necesaria para una regulación precisa de los volúmenes del líquido corporal y las concentraciones de solutos.
Flujo sanguíneo renal y consumo de oxígeno
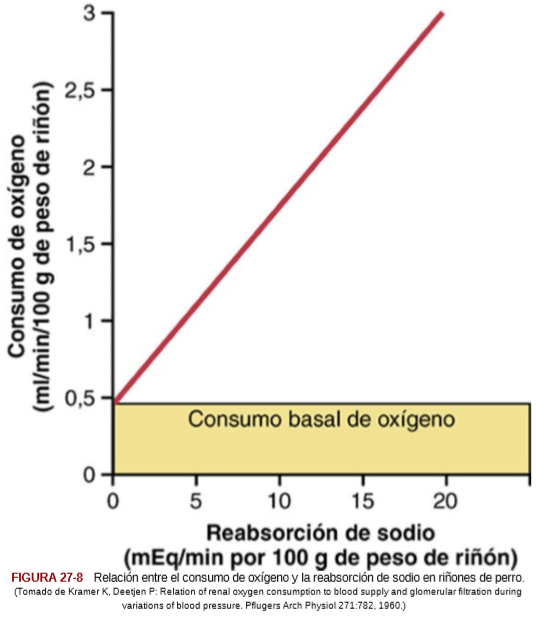
Los riñones consumen normalmente el doble de oxígeno que el encéfalo, pero tienen casi siete veces más flujo sanguíneo. Luego el oxígeno transportado a los riñones supera con mucho sus necesidades metabólicas, y la extracción arteriovenosa de oxígeno es relativamente baja comparada con la de la mayor parte de los restantes tejidos. Una gran fracción del oxígeno consumido por los riñones se relaciona con la elevada reabsorción del sodio en los túbulos renales. Si el flujo renal y la FG se reducen y se filtra menos sodio, se reabsorbe menos sodio y se consume menos oxígeno.
Por tanto, el consumo renal de oxígeno varía en proporción con la reabsorción tubular renal de sodio, que a su vez está muy relacionada con la FG y la velocidad de filtración del sodio
Control fisiológico de la filtración glomerular y del flujo sanguíneo renal
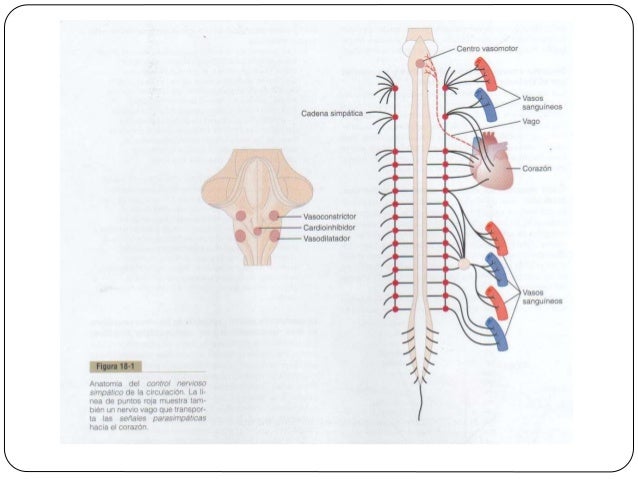
La intensa activación del sistema nervioso simpático reduce la FG
Casi todos los vasos sanguíneos de los riñones, incluidas las arteriolas aferentes y eferentes, están muy inervados por fibras nerviosas simpáticas. La fuerte activación de los nervios simpáticos renales puede contraer las arteriolas renales y reducir el flujo sanguíneo renal y la FG. La estimulación moderada o leve ejerce poca influencia sobre el flujo sanguíneo renal y la FG.
Los nervios simpáticos renales parecen más importantes para reducir la FG durante los trastornos agudos y graves que duran de varios minutos a unas pocas horas, como los provocados por las reacciones de defensa, la isquemia encefálica o la hemorragia grave. En la persona sana en reposo, el tono simpático ejerce poca influencia sobre el flujo sanguíneo renal.
La noradrenalina, la adrenalina y la endotelina contraen los vasos sanguíneos renales y reducen la FG
Las hormonas que constriñen las arteriolas aferentes y eferentes, lo que reduce la FG y el flujo sanguíneo renal, son la noradrenalina y la adrenalina liberadas por la médula suprarrenal. Las concentraciones sanguíneas de estas hormonas van generalmente paralelas a la actividad del sistema nervioso simpático; luego la noradrenalina y la adrenalina ejercen escasa influencia sobre la hemodinámica renal excepto en condiciones extremas, como una hemorragia grave. Otro vasoconstrictor, la endotelina, es un péptido que pueden liberar las células endoteliales vasculares lesionadas de los riñones, así como de otros tejidos. La función fisiológica de estos autacoides no se conoce del todo. Pero la endotelina puede contribuir a la hemostasia (minimizando la pérdida de sangre) cuando se secciona un vaso sanguíneo, lo que lesiona el endotelio y libera este poderoso vasoconstrictor.

Autorregulación de la FG y del flujo sanguíneo renal
Los mecanismos de retroalimentación intrínsecos de los riñones mantienen normalmente el flujo sanguíneo renal y la FG relativamente constantes, a pesar de cambios acentuados en la presión arterial sistémica. Estos mecanismos todavía funcionan en los riñones perfundidos con sangre que se han extraído del cuerpo, independientes de las influencias sistémicas. Esta constancia relativa de la FG y del flujo sanguíneo renal se denomina autorregulación.
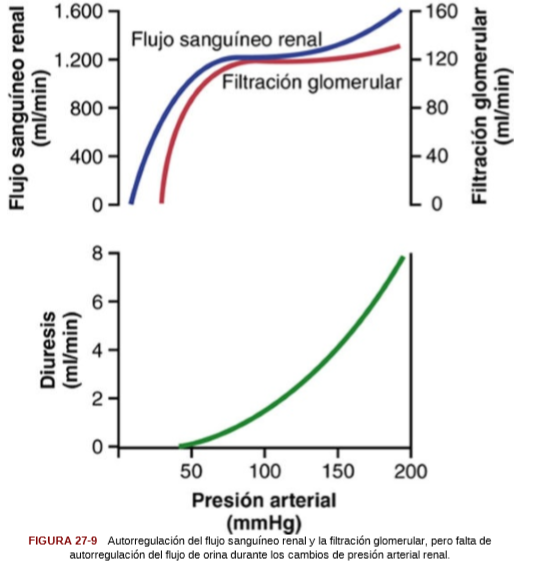
La principal función de la autorregulación del flujo sanguíneo en la mayoría de los tejidos diferentes a los riñones es mantener el reparto de oxígeno y nutrientes en valores normales y la
extracción de los productos de desecho del metabolismo, a pesar de los cambios en la presión arterial. En los riñones, el flujo sanguíneo normal es mucho mayor que el necesario para estas funciones. La principal función de la autorregulación en los riñones es mantener una FG relativamente constante que permita un control preciso de la excreción renal de agua y de solutos.
Retroalimentación tubuloglomerular y autorregulación de la FG
El mecanismo de retroalimentación tubuloglomerular tiene dos componentes que actúan juntos en el control de la FG: 1) un mecanismo de retroalimentación arteriolar aferente, y 2) un mecanismo de retroalimentación arteriolar eferente. Estos mecanismos de retroalimentación dependen de disposiciones anatómicas especiales del complejo yuxtaglomerular

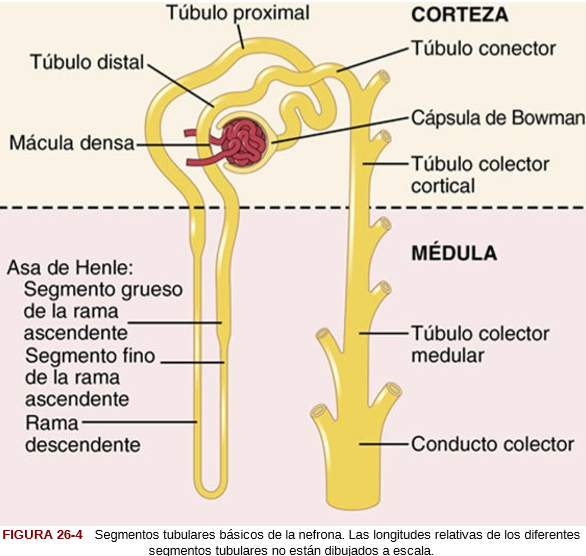
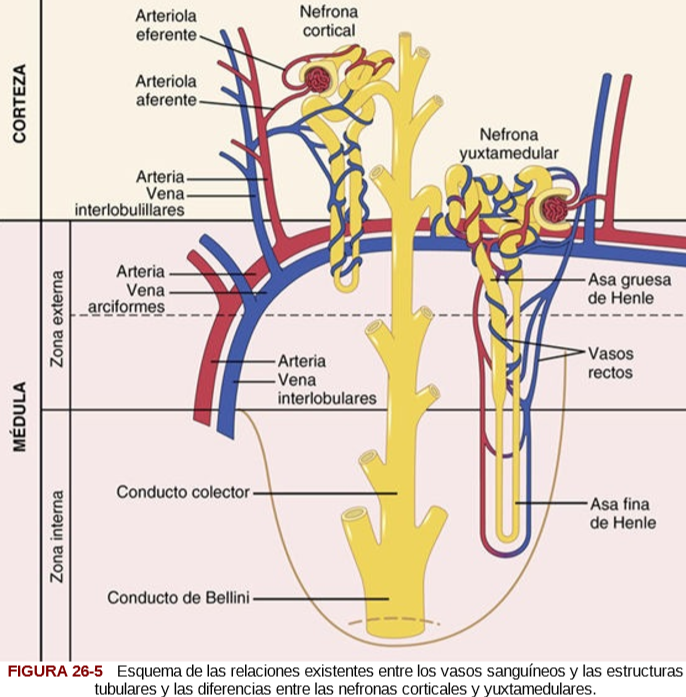
El complejo yuxtaglomerular consta de las células de la mácula densa en la porción inicial del túbulo distal y las células yuxtaglomerulares en las paredes de las arteriolas aferentes y eferentes. La mácula densa es un grupo especializado de células epiteliales en los túbulos distales que entra en estrecho contacto con las arteriolas aferente y eferente. Las células de la mácula densa contienen aparato de Golgi, que son orgánulos secretores intracelulares dirigidos hacia las arteriolas, lo que indica que estas células pueden estar secretando una sustancia hacia ellas.
La reducción del cloruro de sodio en la mácula densa dilata las arteriolas aferentes y aumenta la liberación de renina
Los estudios experimentales hacen pensar que la reducción de la FG disminuye la velocidad del flujo que llega al asa de Henle, lo que aumenta la reabsorción del porcentaje de iones sodio y cloro suministrados a la rama ascendente del asa de Henle, hecho que disminuye la concentración de cloruro de sodio en las células de la mácula densa. Esta reducción de la concentración de cloruro de sodio inicia una señal que parte de la mácula densa y tiene dos efectos:
1) reduce la resistencia al flujo sanguíneo en las arteriolas aferentes, lo que eleva la presión hidrostática glomerular y ayuda a normalizar la FG, y 2) aumenta la liberación de renina en las células yuxtaglomerulares de las arteriolas aferente y eferente, que son los principales reservorios de renina.
Autorregulación miógena del flujo sanguíneo renal y de la FG
Otro mecanismo que contribuye al mantenimiento del flujo sanguíneo renal y de la FG relativamente constantes es la capacidad de cada vaso sanguíneo de resistirse al estiramiento durante el aumento de la presión arterial, un fenómeno denominado mecanismo miógeno.
Aunque el mecanismo miógeno opera probablemente en la mayoría de las arteriolas del cuerpo, su importancia en la autorregulación del flujo sanguíneo renal y de la FG ha sido cuestionada por algunos fisiólogos porque este mecanismo sensible a la presión no tiene medio de detectar directamente por sí mismo cambios en el flujo sanguíneo renal ni en la FG. Por otra parte, este mecanismo puede ser más importante para proteger el riñón de lesiones inducidas por hipertensión. Como respuesta a aumentos repentinos en la presión sanguínea, la respuesta de contracción miógena en las arteriolas aferentes tiene lugar en unos segundos y, por tanto, atenúa la transmisión del aumento de la presión arterial a los capilares glomerulares.
Otros factores que aumentan el flujo sanguíneo renal y la FG: ingestión elevada de proteínas y aumento de la glucemia
Se sabe que una ingestión elevada de proteínas aumenta el flujo sanguíneo renal y la FG. Con una dieta rica en proteínas de larga duración, como la que contiene grandes cantidades de carne, los incrementos en la FG y en el flujo sanguíneo renal se deben en parte al crecimiento de los riñones. Sin embargo, la FG y el flujo sanguíneo renal aumentan también un 20-30% en las 1 a 2 h siguientes a la ingestión de una
comida rica en proteínas.
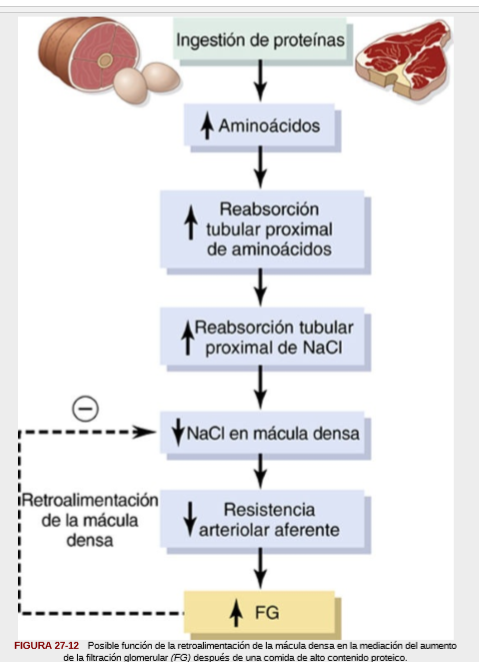
Un mecanismo similar puede explicar también los incrementos acentuados en el flujo sanguíneo renal y la FG que se producen con aumentos grandes de la glucemia en personas con diabetes mellitus incontrolada. Debido a que la glucosa, como algunos aminoácidos, también se reabsorbe junto con el sodio en el túbulo proximal, una mayor llegada de glucosa a los túbulos les hace reabsorber un exceso de sodio junto a la glucosa. Esta reabsorción del exceso de sodio reduce, a su vez, la concentración de cloruro de sodio en la mácula densa, lo que activa la dilatación mediada por la retroalimentación tubuloglomerular de las arteriolas aferentes y los posteriores aumentos del flujo sanguíneo renal y de la FG.